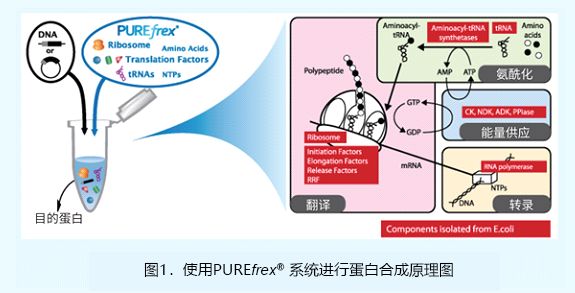
PUREfrex® 试剂盒是在东京大学的Takuya Ueda教授所发明的PUREsystem技术基础上,新开发的一款重组合无细胞蛋白合成试剂盒。
该反应系统由蛋白、核糖体、氨基酸和、NTPs组成。进行蛋白表达仅需将编码目标蛋白的模板DNA或mRNA加入到反应体系中,然后孵育2-4小时即可完成反应,且无需担心高背景影响到下游应用。
本试剂盒是各组分经过纯化再重新组合而成,而非直接从大肠杆菌中提取,RNase、β-半乳糖苷酶以及脂多糖(LPS)污染已受到严格控制。PUREfrex® 试剂盒中的所有蛋白组分都不带标签,因此目的蛋白可融合任意标签进行纯化和检测。
● 可以同时加入多种模板进行反应,以合成Fab(带二硫键)及多聚体等带二级结构的多肽
● 单位体积内合成的蛋白量几乎恒定,不随反应体积变化而产生显著差异
以下为PUREfrex® 已经过实验验证的应用功能,如需进一步数据,请联系在线客服索取技术资料。
已知若改变合成蛋白的起始密码子后的2-6号氨基酸密码子,合成蛋白的量会有很大的差异。这是以曲妥珠单抗(商品名赫赛汀)的Fab重链(VH+CH1)为模型,制备56种不同的密码子模板,比较其合成量。
在带His tag的Nanodisc上合成膜蛋白,进行亲和纯化的步骤时,即可从反应产物中纯化膜蛋白。
α-Synuclein的N端带有His tag时合成蛋白,根据His tag序列的不同,有时合成量会降低。合成量的降低,只需更改His tag的基因序列就可以改善。
用PUREfrex® 1.0 和PUREfrex® 2.0 试剂盒中含有的DHFR制备带有His tag的模板DNA作为对照,并展示了用Ni亲和柱纯化后的结果。
Fab是轻链(LC)和重链(HC)在分子内形成二硫键并缔合变活性型。向PUREfrex® 2.0 反应液中添加DS supplement合成Fab抗体后的结果显示,合成了可以和抗原结合的活性Fab抗体。另外,通过最优化轻链(LC)和重链(HC)的模板DNA的添加比例,活性型Fab抗体的回收量也上涨了。
轻链(LC)和重链(HC)形成的Fab中,为了提高重链(HC)的合成量,通过向碱基序列中导入沉默突变,并改变5’端处的9个氨基酸的GC含量,调查其对合成量的结果显示,AT含量越高,合成量就有可能越高。
用PUREfrex® 1.0 和PUREfrex® 2.0 分别合成相同的蛋白,比较其合成量以及活性。
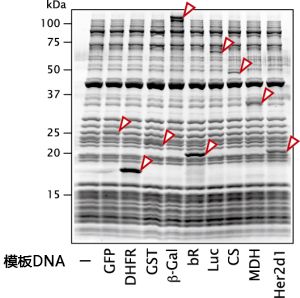
通过向PUREfrex®(#PF001)的反应体系中添加DNA(或mRNA)并进行反应,不仅可以合成原核生物来源的蛋白,也可以合成真核生物来源的蛋白。例如,合成大肠杆菌的DHFR时,一个试剂盒(500 μL)可以合成50 μg以上的DHFR。下图的电泳是反应产物。
● GFP : Green fluorescent protein *
● DHFR : Dihydrofolate reductase
● GST : Glutathione S-transferase
● β-Gal : β-Galactosidase
● CS : Citrate synthase *
● MDH : Malate dehydrogenase *
● Her2d1 : Domain1 of Her2 *
使用添加了GroE Mix的PUREfrex® 1.0,合成4类大肠杆菌蛋白(FadA、HemB、PepQ、PyrC)*1),检测合成产物的可溶性。
*1)FadA, HemB, PepQ, PyrC是大肠杆菌内作为GroE的底物被报道的蛋白
(Ref; Fujiwara et al. (2010) EMBO J, 29, 1552-1564)
使用添加了DnaK Mix的PUREfrex® 合成荧光素酶,检测合成产物的活性。
合成有SS键的蛋白
在不同浓度的大肠杆菌DsbC存在下合成含有复数的二硫键蛋白,vtPA(truncated version of tissue plasminogen activator)和AppA(大肠杆菌酸性磷酸酶),并比较它们的活性。
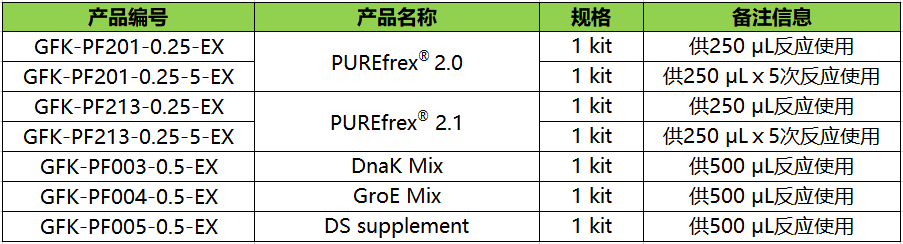
● PUREfrex® 已升级到2.0,比第一代产品表达量更高,污染物水平更低
● PUREfrex® 2.1 比2.0更适合二硫键的形成